RP3: iPSC Modelle, CRISPR/Cas Organoide
Das Teilprojekt 3 „iPS-Zell-Modelle und CRISPR/Cas-editierte Organoide“ zielt darauf ab, die molekularen Folgen von Veränderungen in Cholestase-assoziierten Genen mit patienten-spezifischen Proben zu analysieren.
Mit unseren Zellkultur-Methoden können wir 3D-Leber-Organoide aus patientenabstammenden iPS-Zellen züchten, die hepatobiliäre Transporter wie ABCC2 (MRP2) und OATP2B1 in der apikalen bzw. basolateralen Membrandomäne der Leberzellen aufweisen. Für eine punktgenaue Korrektur der Cholestase-assoziierten Genmutationen haben wir verschiedene CRISPR/Cas9-Systeme etabliert. Das „Prime Editing“-Verfahren kann dabei mit der Lotsen-RNA noch eine verlängerte Sequenz in die Zellen einbringen, die als Blaupause während der DNA-Reparatur dient. Damit können ideale Kontrollzellen generiert werden, um den Einfluss bestimmter Genmutationen präzise von Effekten anderer Faktoren abgrenzen zu können.
Konkret untersuchen wir:
- Leber-Organoid-Assays für quantitative Analysen des veränderten hepatobiliären Transports: Mit Hilfe fluoreszierender Substrate und Gallensäurederivate wie Cholyl-Lysyl-Fluorescein (CLF) oder Tauro-nor-THCA-24-DBD können wir den MRP2- (ABCC2) und BSEP- (ABCB11)-vermittelten Transport für quantitative Funktionstests bestimmen.
- In vitro-Modellierung von FXR (NR1H4)-Mutationen: Die funktionellen Folgen von Mutationen im Gallensäurerezeptor FXR (NR1H4) werden in von Patienten stammenden iPSCs und in CRISPR/Cas9-gezüchteten iPSCs mit einem vollständigen FXR-Knock-out unter Verwendung von Leberorganoiden untersucht.
- Bewertung von Verbindungen und Arzneimitteln zur Verbesserung der hepatobiliären Verbindungen: Die Differenzierung von patientenspezifischen hepatobiliären Organoiden soll an ein 384-Well-Mikrotiterplattenformat angepasst werden, um potenzielle Modulatoren der hepatischen Transportpumpen BSEP (ABCB11), MRP2 (ABCC2) und FIC1 (ATP8B1) zu untersuchen.
Das Teilprojekt RP3 wird an der Medizinischen Hochschule Hannover (Projektleiter: Prof. Dr. Tobias Cantz, wissenschaftlicher Mitarbeiter: Dr. Malte Sgodda) durchgeführt.
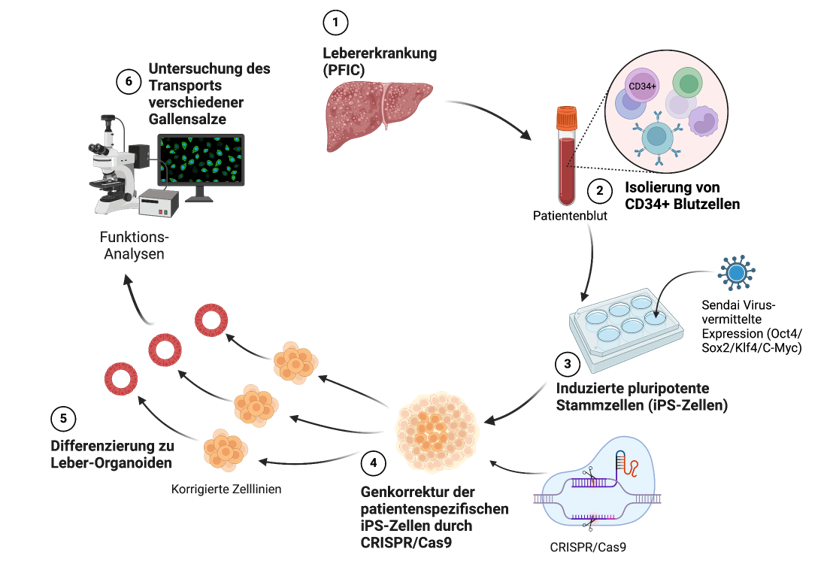
Abbildung 1: Schematische Darstellung der Methoden.
Von Patienten mit schwerer PFIC-assoziierter Leberschädigung (1) können Blutzellen gewonnen werden (2), und zu induzierten pluripotenten Stammzellen (iPS-Zellen) reprogrammiert werden (3). Diese Zellen lassen sich relativ einfach einzel-zellig vermehren, so dass sie mittels CRISPR(Cas9-basierter Verfahren genetisch verändert bzw. korrigiert werden können (4). Verschiedener solcher korrigierter Zelllinien lassen sich anschließend in Leber-Organoide (5) differenzieren, welche dann für funktionelle Analysen des hepatobiliären Transport (6) eingesetzt werden können.
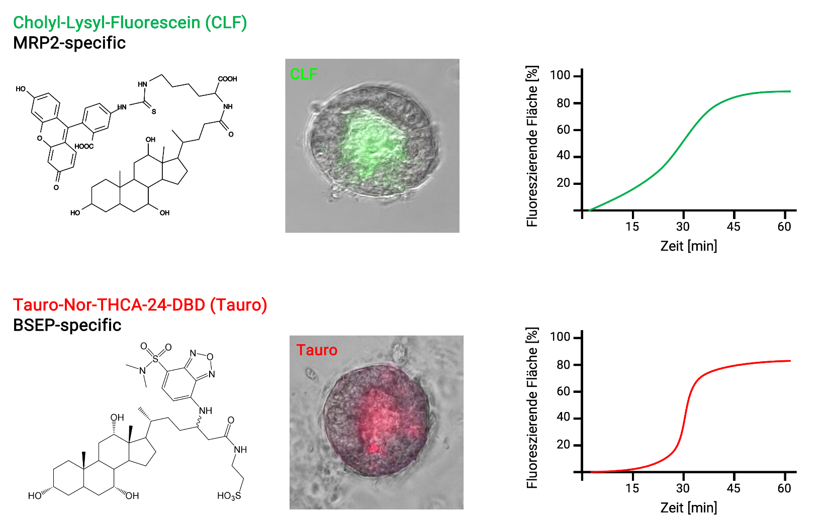
Abbildung 2: Transport fluoreszierender Substrate.
Der MRP2-vermittelte Transport in luminale/kanalikuläre Strukturen der Leber-Organoide lässt sich mit dem grün-fluoreszierenden Gallensalz-Konjugat Cholyl-Lysyl-Fluorescein (CLF) charakterisieren. Für Untersuchungen des BSEP-vermittelte Transports lässt sich das mit einem roten Fluorophor-markierte Gallensalz Tauro-Nor-THCA-24-DBD (Tauro) einsetzen. Für beide Substrate zeigt sich in unserem Analyse-System ein aktiver, zeitabhängiger Transport, der nach ca. 45 Minuten eine Plateau-Phase erreicht.





